Разработать рекомендации по внесению изменений в клиническую практику Республики Казахстан с целью использования в профилактических мероприятиях и фармакотерапии генетической предрасположенности к развитию заболеваний и эффективности препаратов
- ИССЛЕДОВАНИЯ ГЕНЕТИЧЕСКОЙ ЭПИДЕМИОЛОГИИ КОРОНАВИРУСНОЙ ИНФЕКЦИИ В КАЗАХСТАНЕ С АНАЛИЗОМ ДНК ЛИЦ, ПЕРЕБОЛЕВШИХ COVID-19 ДЛЯ ОЦЕНКИ ПРОГНОЗИРОВАНИЯ ТЕЧЕНИЯ, ТЯЖЕСТИ И ИСХОДОВ КОРОНАВИРУСНОЙ ИНФЕКЦИИ в рамках реализации научно-технической программы «Национальная программа внедрения персонализированной и превентивной медицины в Республике Казахстан»
- АНАЛИЗ ДНК ЛИЦ КАЗАХСКОГО ЭТНОСА, СТРАДАЮЩИХ ЗНАЧИМЫМИ ЗАБОЛЕВАНИЯМИ И КОНТРОЛЬНЫХ ЛИЦ КАЗАХСКОГО ЭТНОСА С ЦЕЛЬЮ ОПРЕДЕЛЕНИЯ ПОЛИМОРФИЗМА ГЕНОВ, АССОЦИИРОВАННЫХ С РАЗВИТИЕМ ДАННЫХ ЗАБОЛЕВАНИЙ С ПОСЛЕДУЮЩЕЙ РАЗРАБОТКОЙ РЕКОМЕНДАЦИЙ в рамках реализации научно-технической программы «Национальная программа внедрения персонализированной и превентивной медицины в Республике Казахстан»
- РАЗРАБОТКА РЕКОМЕНДАЦИЙ ПО ВНЕСЕНИЮ ИЗМЕНЕНИЙ В КЛИНИЧЕСКУЮ ПРАКТИКУ РЕСПУБЛИКИ КАЗАХСТАН С ЦЕЛЬЮ ИСПОЛЬЗОВАНИЯ В ФАРМАКОТЕРАПИИ ГЕНЕТИЧЕСКОЙ ПРЕДРАСПОЛОЖЕННОСТИ К ЭФФЕКТИВНОСТИ И РАЗВИТИЮ ПОБОЧНЫХ ЭФФЕКТОВ ОТ ЛЕКАРСТВЕННЫХ СРЕДСТВ в рамках реализации научно-технической программы «Национальная программа внедрения персонализированной и превентивной медицины в Республике Казахстан»
- ГЕНЕТИЧЕСКАЯ ПАСПОРТИЗАЦИЯ И АНАЛИЗ ПОЛИМОРФИЗМОВ В ГЕНАХ, АССОЦИИРОВАННЫХ С РЕЗИСТЕНТНОСТЬЮ К ФТОРХИНАЛОНАМ И АМИНОГЛИКОЗИДАМ, ДЛЯ ВЫБОРКИ ШТАММОВ M. TUBERCULOSIS, ВЫДЕЛЕННЫХ ОТ ПАЦИЕНТОВ НА ТЕРРИТОРИИ РЕСПУБЛИКИ КАЗАХСТАН, А ТАКЖЕ ТАРГЕТНОЕ СЕКВЕНИРОВАНИЕ ГЕНОВ В СЛУЧАЕ РАСХОЖДЕНИЯ ФЕНОТИПИЧЕСКИХ И ГЕНЕТИЧЕСКИХ ПРИЗНАКОВ ЛЕКАРСТВЕННОЙ УСТОЙЧИВОСТИ ЭТИХ ШТАММОВ ДЛЯ ОПРЕДЕЛЕНИЯ НОВЫХ СТАТИСТИЧЕСКИ ЗНАЧИМЫХ МАРКЕРОВ И РАЗРАБОТКИ РЕКОМЕНДАЦИЙ в рамках реализации научно-технической программы «Национальная программа внедрения персонализированной и превентивной медицины в Республике Казахстан»
Актуальность
Пандемия COVID-19 затронула более 23 миллионов пациентов с более высоким уровнем смертности в 200 странах. Учитывая сложившуюся ситуацию в мире и в нашей стране в связи с пандемией COVID-19 вся медицинская общественность и Правительство Республики Казахстан заняты разработкой мер против распространения вируса в стране и обеспечения лечения. Как известно, ПЦР с обратной транскриптазой в реальном времени (RT-qPCR), нацеленная на обнаружение РНК SARS-CoV-2, может быть эффективной при идентификации инфицированных лиц для изоляции и отслеживания контактов, однако данный метод не имеет эффективности для определения того, какие вирусные штаммы циркулируют в сообществе. Важно знать происхождение штаммов, что, в свою очередь, влияет на решения в области политики общественного здравоохранения. Кроме того, жизненно важно идентифицировать события суперраспространителя, поскольку на них может влиять штамм вируса. В мире инициированы исследования генетики коронавируса, генетики человека, взаимосвязи течения и тяжести коронавирусной инфекции от различных внешних и внутренних (организм человека) факторов риска. Генетический анализ и наблюдение позволяют охарактеризовать циркулирующие вирусные линии, сделать вывод о событиях интродукции и реконструировать схемы передачи. Секвенирование генома вирусов используется для изучения распространения болезней во время вспышек заболеваний. На сегодняшний день неизвестно, какие могут быть последствия перенесенной коронавирусной инфекции, и какой прогноз ожидать по эпидемиологической ситуации в мире, а само течение и тяжесть заболевания отличается у разных людей. Изучение эпидемиологии коронавирусной ифекции, генетической эпидемиологии, факторов, влияющих на течение заболевания и исходы, генетики вируса поможет разработать меры борьбы с эпидемией вируса. Вместе с эпидемиологическими данными генетическая эпидемиология представляют собой мощные инструменты для содействия инициативам в области общественного здравоохранения и обеспечения готовности. Геномный надзор в режиме реального времени важен для управления вирусными вспышками, поскольку он может дать представление о том, как вирусы передаются, распространяются и эволюционируют. Такая работа зависит от быстрого секвенирования вирусного материала непосредственно из клинических образцов, т. е. без необходимости выделения вируса в чистой культур. В рамках данной подзадачи будут исследованы ДНК пациентов, инфицированных коронавирусной инфекцией, будет проведено секвенирование геномов пациентов с коронавирусом для выявления взаимосвязи клинического течения инфекционного процесса и индивидуальных особенностей организма человека, тем самым полученные результаты могут использоваться в борьбе с эпидемией коронавируса,
Цель данного исследования
Дать оценку прогнозирования предрасположенности, течения и исходов коронавирусной инфекции с анализом ДНК лиц, переболевших COVID-19, и генотипирования возбудителя.
Задачи исследования
1. Формирование выборки участников исследования. 2. Выделение РНК коронавируса. Генетическое исследование коронавируса, циркулирующих на территории Казахстана. 3. Выделение ДНК. 4. Проведение и анализ данных секвенирования полных геномов.
Научная новизна: Впервые будет проведено исследование генетической эпидемиологии коронавирусной инфекции в Казахстане с анализом ДНК лиц, с положительным результатом теста ПЦР на наличие COVID-19 для оценки прогнозирования течения, тяжести и исходов коронавирусной инфекции
Дизайн исследования
Целевая выборка Общее количество: 1200 человек, сплошная выборка, выборка производиться по 16 регионам Республики Казахстан
Исследование планируется провести на базах филиалов лаборатоий ИНВИВО и на базе лаборатории коллективного пользования КазНМУ им.С.Д, Асфендиярова. Исследование по оценки прогнозирования предрасположенности, течения и исходов коронавирусной инфекции с анализом ДНК лиц, переболевших COVID-19, и генотипирования возбудителя будет проводиться в 2 этапа: 1 этап исследования будет произведен на базе лаборатории ИНВИВО. Методом сплошной выборки, рандомизированно будет произведен набор 1200 пациентов с подтвержденным диагнозм COVID-19 по результатам ПЦР тестирования с учетом соблюдения всех карантинных мер и мер безопасности. Будут отобраны лица с подтвержденным COVID-19 с различным течением и тяжестью заболевания, из разных возрастных групп, мужчин и женщин. У исследуемых будет произведен забор мазка из носоглотки и зева, из полученного образца будет проведена изоляция и экстрацкия РНК SARS-CoV-2. Изоляцию вируса и экстракцию РНК будут проводить в лаборатории ИНВИВО уровня биобезопасности (BSL) 2+ с защитой BSL-3. Будут собраны мазки из носоглотки и ротоглотки у 1200 пациентов с положительными результатами RT-qPCR, проживающих в 16 регионах Республики Казахстан: Алматы, Алматинская область, Жамбылская, Туркестанская, Актюбинская область, Павлодарская, Карагандинская, Северо-Казахстанская, Мангистауская, г.Нур-Султан, Западно-Казахстанская, Атырауская, Акмолинская, Костанайская, Восточно-Казахстанская, Кызылординских областях. Образцы будут выбраны на основе значений порога цикла (Ct) ≤ 32. с COVID-19, подтвержденных qPCR. Также будут собраны эпидемиологические данные, такие как симптомы, клинико-демографические данные из медицинских записей, сопровождающих собранные образцы. 2 этап исследования будет произведен на базе Лаборатории коллективного пользования КазНМУ им. С.Д. Асфендиярова. Данные по материалам РНК полученных из образцов непосредственно лабораторией ИНВИВО будут направлены и транспортированы в Лаборатории коллективного пользования КазНМУ им. С.Д. Асфендиярова.
Целевые индикаторы: База с результатами полногеномного секвенирования вируса SARS-COV 2. База клинически значимых генетических маркеров COVID-19. База по серопревалентности COVID-19 и их ассоциация с течением заболевания и неблагоприятным прогнозом.
Исполнитель исследования: КазНМУ им.С.Д.Асфендиярова
Актуальность
Сегодня такие базы генетических данных как ClinVar (NIH), HGMD (Institute of Medical Genetics, Cardiff) и др., а также огромное количество публикаций содержат информацию касательно прогностических полиморфизмов с доказанной на других этносах (европейцы, дальневосточные народы и др.) ассоциацией с развитием заболеваний. Вместе с тем, для внедрения вышеупомянутых результатов в клиническую практику Республики Казахстан возникает необходимость валидизации данных полиморфизмов генов у лиц казахского этноса, т.е. выявления наличия или отсутствия и силы связи отобранных полиморфизмов с заболеваниями именно у лиц казахского этноса. Кроме этого, учитывая, что в рамках данной подзадачи планируется генотипирование порядка 2,5 млн. полиморфизмов по каждой нозологии, возникает вероятность нахождения новых значимых полиморфизмов предрасположенности к развитию заболеваний. В результате, будут выявлены либо валидизированы полиморфизмы генов, обладающие высокой прогностической и, следовательно, клинической значимостью у лиц казахского этноса. Внедренческий этап данной подзадачи заключается во разработке рекомендаций и дополнений в клинические протокола Республики Казахстан, описывающие процедуру выявления генетической предрасположенности к развитию изученных заболеваний, а также описывающие процедуру ведения людей, с выявленной генетической предрасположенностью. К примеру, в случае если поступает пациент с раком желудка, больному будет назначен ПЦР анализ и в случае выявления полиморфизмов, высокая значимость в развитии рака желудка которых была доказана в Программе (т.е. включенные в клинические протоколы), всем близким родственникам пациента (родители, родные братья и сестры, дети) будет предписано прохождение теста на наличие найденных у пациента мутаций. В случае их выявления, до близкого родственника будет доведено, что он обладает повышенным риском и ему будут даны рекомендации по профилактике рака желудка. Вместе с тем, как известно, информированность о риске возникновения заболевания далеко не всегда гарантирует соблюдение всех предписаний. В этой связи родственник с выявленной предрасположенностью будет включен в группу риска, из которой будет формироваться список лиц для обязательного прохождения скрининга, контроль прохождения которого, в перспективе и по опыту стран ОЭСР, будет осуществляться за счет повышения размера отчислений с заработной платы в пользу Фонда обязательного медицинского страхования в случае игнорирования скрининга. Клинически значимые полиморфизмы для включения в клинические протокола для лиц русского этноса будут отобраны по публикациям многочисленных генетических исследований, уже проведенных в Российской Федерации. Кроме того, ввиду чрезвычайно высокой генетической схожести восточнославянских этносов, полученные результаты можно будет экстраполировать на лиц украинского и белорусского этносов, таким образом (в совокупности с казахским этносом), охватывая свыше 90% населения Республики Казахстан.
Цель данного исследования
Изучение генетических факторов, предрасполагающих к развитию 12 видов значимых заболеваний в казахской популяции.
Задачи исследования
1. Разработка критериев включения и исключения. 2. Сбор биоматериала (образцов крови) у лиц казахской национальности с 12 видами значимых нозологий в анамнезе 3. Генотипирование на чипах высокой плотности ДНК лиц с 12 видами значимых нозологий в анамнезе и лиц из контрольных групп.
Дизайн исследования В исследовании будут принимать участие лица казахской национальности (в третьем поколении) (бабушка и дедушка по отцовской и материнской линии). Объем исследования: 2,5 млн. полиморфизмов, с частотой встречаемости более 1% в общей популяции (GWAS). Список нозологий и объем выборки: • Рак молочной железы (1200 больных); • Артериальная гипертензия (1200 больных); • Эпилепсия (600 больных и 300 контроль); • Острое нарушение мозгового кровообращения при преэклампсии (100 больных и 100 контроль); • Шизофрения (1200 больных); • Цирроз печени (1000 больных и контроль); • Бронхиальная астма (300 больных и 300 контроль); • Инфаркт миокарда (1200 больных); • Б-линейные лимфома и лейкоз у детей (200 больных и 200 контроль); • Атопический дерматит (900 больных); • Идиопатический гонартроз (300 больных и 300 контроль); • Идеопатический сколиоз (200 больных и 200 контроль); • Лица, переболевшие COVID-19 (1200 больных); • Популяционный контроль 3000. Методы исследования: • Генотипирование на чипах с высокой плотностью (сканер биочипов высокой плотности iScan System с автоматизированной системой прободготовки, Illumina); • Генотипирование со средней плотностью при помощи ПЦР в режиме реального времени; • Бионформатический анализ.
Соисполнители исследования: НАО КазНМУ им. С.Д. Асфендиярова, НАО «Медицинский университет Астана» , АО «Научный центр акушерства, гинекологии и перинатологии», АО «Казахский научно-исследовательский институт онкологии и радиологии» , РГП «Больница Медицинского центра Управления Делами Президента Республики Казахстан», АО «Научно-исследовательский институт кардиологии и внутренних болезней» , АО «Национальный научный кардиохирургический центр», РГП на ПХВ «Республиканский научно-практический центр психического здоровья» МЗ РК, АО «Национальный научный центр хирургии им. А.Н. Сызганова», АО «Научный центр педиатрии и детской хирургии» , РГП на ПХВ «Национальный научный центр фтизиопульмонологии» МЗ РК, РГП «Научно-исследовательский институт травматологии и ортопедии» МЗ РК, РГП на ПХВ «Научно-производственный центр трансфузиологии» МЗ РК.
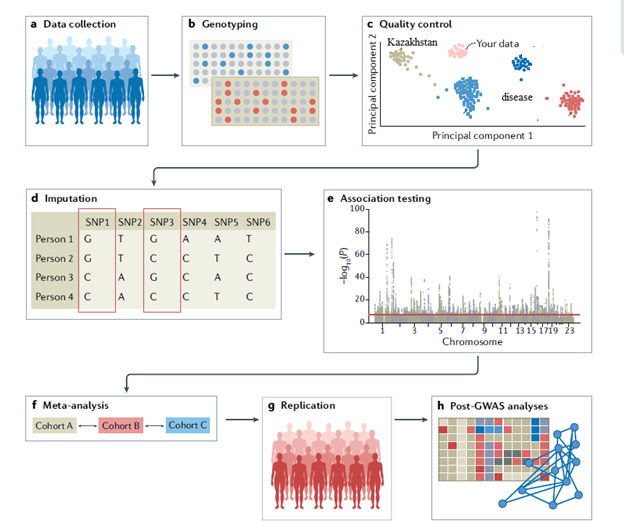
Рисунок 1 – Обзор последовательных шагов для проведения GWAS исследования
Актуальность
В рамках данной подзадачи будет проведен обзор публикаций по фармакогенетическим исследованиям, а также фармакогенетической базы PharmGKB (NIH) с целью отбора лекарственных средств, обладающих достоверно доказанными генетическими ассоциациями с эффективностью усвоения и развитием побочных эффектов. Вторым критерием отбора будет являться актуальность необходимости своевременного подбора правильного лекарственного средства и его дозировки. Затем будет проведен статистический анализ частоты встречаемости полиморфизмов, ассоциированных с эффективностью усвоения и развитием побочных эффектов отобранных препаратов. На основе полученных результатов будут разработаны рекомендации по внесению изменений в клинические протокола Республики Казахстан, описывающие процедуру выявления фармакогенетических особенностей при приеме лекарственных средств, т.е. генетической предрасположенности к эффективности препаратов и развитию побочных эффектов перед их назначением врачом. К примеру, в случае если больному после перенесенной операции планируется назначить антикоагулянт, обладающий фармакогенетическими особенностями, то пациент предварительно проходит ПЦР исследование по результатам которых проводят расчет индивидуальной дозировки препарата. В случае обнаружения генетической предрасположенности к чрезмерно высокой усвояемости либо развитию серьезных побочных эффектов, пациенту назначается другой препарат. Таким образом, к примеру, в разы снижается риск тромбообразования в постоперационный период. Другой яркий пример – это противосудорожные препараты. Своевременный подбор нужных препаратов крайне важен для детей эпилептиков, так как с каждым приступом происходит деградация его умственной активности, которая в итоге приводит к уже необратимой инвалидизации. Своевременный подбор правильного нейролептика предотвращает десоциализацию и госпитализацию в случае агрессивной либо крайне десоциализированной формы психического расстройства. В Республике Казахстан свыше 50% больных психическими заболеваниями относятся именно к такой группе. Своевременная идентификация генетических предикторов эффективной иммуносупрессивной терапии после трансплантации позволит индивидуализировать назначение цитостатиков и снизить риск отторжения, тем самым спасая жизнь пациента. В целом, персонализированная фармакотерапия наиболее важна в онкологии, так как сегодня дорогостоящие онкологические препараты (1-3 млн. тенге) в Республике Казахстан назначаются вслепую, в результате чего страдает бюджет страны, а самое главное, умирают люди, которых можно было бы спасти, в случае своевременного подбора препарата, эффективного для данного конкретного пациента. Кроме того, еще одним важным результатом данной задачи будет пересмотр видов и объемов лекарственных средств, закупаемых государством с учетом статистически доказанной генетической предрасположенности казахстанцев к препаратам.
Перспективы фармакогенетических исследований
На сегодняшний день создано несколько фармакогеномных объединений мирового научного сообщества, чья цель направлена на оценку исходов лекарственной реакции, так например: - PharmGKB - это ресурс знаний по фармакогеномике, который включает в себя клиническую информацию, включая клинические руководства по ассоциации «гены-лекарственные препараты» и взаимосвязи «генотип-фенотип». PharmGKB собирает, хранит и распространяет информацию о влиянии генетических вариаций человека на лекарственную эффективность Сотрудничество в рамках данной задачи с международным участием позволит: - Разработать генетические варианты и определить взаимосвязь между геномом, лекарственным препаратом и заболеванием (с помощью обзора литературы). - Обобщить важные фармакогеномные SNP, а также изучить их связь между генетическими вариантами SNP и лекарственными препаратами - Курировать и участвовать в написании руководств по дозированию лекарственных средств на основе фармакогеномики - Публикация руководств по дозированию лекарственных средств, основанных на фармакогеноме Таким образом, полногеномные ассоциативные исследования (GWAS) оказались одним из главных инструментов для картирования генов человека, а также демонстрируют их потенциал в фармакогеномных исследованиях. Практические руководства, связанные с дизайном исследования и доступными размерами выборки, подчеркивают необходимость творческих методов репликации, выходящих за рамки традиционных когорт репликации, которые используются для общей генетики.
Цель данного исследования
Разработать рекомендации по внесению изменений в клиническую практику Республики Казахстан с целью использования в фармакотерапии генетической предрасположенности к эффективности и развитию побочных эффектов от лекарственных средств.
Задачи исследования • Отбор препаратов, обладающих генетической предрасположенностью к эффективности и развитию побочных эффектов.
• Статистический анализ распространенности полиморфизмов, ассоциированных с аномальной предрасположенностью к эффективности и развитию побочных эффектов
Дизайн исследования
Объем выборки: лица казахского этноса в третьем поколении по следующим нозоологиям:
Нозология Осн. группа Ответ. организация за анализ 1. Рак молочной железы 700 КазНИИОР 2. Артериальная гипертензия 400 ННКЦ 400 3. Эпилепсия 600 МУА 4. Шизофрения 700 РНПЦПЗ 5. Инфаркт миокарда 500 НИИКВБ 300 6. Атопический дерматит 600 КазНМУ 7. Лица, переболевшие COVID-2019 600 КазНМУ
Исполнитель исследования: КазНМУ им.С.Д.Асфендиярова
Актуальность
Казахстан с уровнем первичного туберкулеза с множественной лекарственной устойчивостью (МЛУ-ТБ) – 24,6% занимает второе место из 27 стран ЕвроВОЗ с высоким бременем МЛУ ТБ, большое развитие и распространение которого сформировалось в 1990х годах. Продолжительность терапии МЛУ ТБ в соответствии с рекомендациями ВОЗ составляет не менее 20 месяцев и более, требует применения более дорогостоящих и хуже переносимых препаратов второго ряда, а успех в лечении не превышает в среднем 55% по миру. Более того, стоимость терапии МЛУ ТБ превышает стоимость лечения лекарственно-чувствительного туберкулеза в 8 раз и более и требует больших организационных усилий со стороны национальных противотуберкулезных программ. Так, стоимость лечения МЛУ ТБ в разных регионах мира варьирует от 3000 до 10,000 долларов США для стандартного курса терапии. Сегодня во многих странах мира лечение МЛУ ТБ является серьезной проблемой общественного здравоохранения. При ненадлежащем лечении МЛУ ТБ или при первичном заражении развивается более тяжелая форма туберкулеза, носящая название туберкулез с преширокой и широкой лекарственной устойчивостью (ШЛУ ТБ). ШЛУ ТБ может развиться во время лечения МЛУ ТБ препаратами резервного ряда при их неправильном и ненадлежащем использовании, пропуске приема препаратов. В связи с чем, возможности терапии ШЛУ ТБ на сегодня крайне ограничены в виду отсутствия необходимого перечня действующих препаратов – эффективность лечения доступными препаратами второго ряда не превышает 30%. Уровень смертности среди пациентов с ШЛУ ТБ на сегодня превышает 70% в течение двух лет после установления диагноза и, более того, такие пациенты несут серьезную опасность для окружающих. В Казахстане также из года в год растет число регистрируемых случаев туберкулеза с широкой лекарственной устойчивостью. На сегодня зарегистрировано свыше 550 случаев ШЛУ ТБ, еще 10% от зарегистрированных МЛУ ТБ (6998 больных) имеют преШЛУ ТБ, т.е. резистентность либо к фторхинолонам, либо к инъекционным препаратам второго ряда. При отсутствии надлежащего лечения прогнозное число больных ШЛУ ТБ к 2020 году в стране составит более 2000 человек. Из заразившихся от них населения в год 1-2 человека будут заболевать туберкулезом с первичной ШЛУ. Сегодняшняя схема лечения ШЛУ ТБ мало эффективна (36,8%) с высоким процентом рецидивов. При этом стоимость данной схемы лечения составляет в среднем 10 тыс. долларов, не считая их содержания и прочие услуги. Наличие проблемы внутрибольничного распространения лекарственно-устойчивых штаммов M. tuberculosis путем их передачи от пациента к пациенту делает неэффективной схему выбранного лечения, поскольку профиль резистентности нового штамма не соответствует профилю первичного. В данной ситуации категорически необходимо внедрение инновационных персонализированных подходов по ДНК-дактилоскопии возбудителя для контроля его стабильности на этапах лечения пациента. В то же время, внедрение индивидуальных схем лечения с новыми противотуберкулезными препаратами является единственной мерой контроля над ростом и распространением преШЛУ и ШЛУ ТБ. В сложившейся ситуации особую актуальность приобретают вопросы, связанные с лабораторной диагностикой туберкулеза и лекарственной устойчивости для разработки новой методики персонализированного подхода в лечении тяжелой формы туберкулеза преШЛУ и ШЛУ ТБ. Продуманное применение доступных качественных методов диагностики и разумное формирование схем лечения пациентов, позволят обеспечить рациональное использование ресурсов. В Казахстане впервые предлагается проект, сочетающий в себе использование такого масштабного комплекса молекулярно-генетических и бактериологических методов, для изучения штаммов M. tuberculosis с пре-ШЛУ и ШЛУ ТБ, циркулирующих на территории страны. В результате проекта будет накоплен и проанализирован массив клинических и генетических данных, полученных с применением персонализированного подхода, обеспеченного методами ДНК-дактилоскопии микроорганизмов, при детализированном изучении природы широкой лекарственной устойчивости возбудителя туберкулеза.
Цель данного исследования
Дать оценку полиморфизмам в генах, ассоциированных с резистентностью к фторхиналонам и аминогликозидам, для выборки штаммов M. tuberculosis, выделенных от пациентов на территории Республики Казахстан, а также таргетное секвенирование генов в случае расхождения фенотипических и генетических признаков лекарственной устойчивости этих штаммов. Задачи исследования
Сбор, систематизации и помещение на долгосрочное хранение микобактериальных культур Определение лекарственной чувствительности клинических изолятов к препаратам второго ряда с использованием фенотипических и молекулярно-генетических тестов Выделение ДНК из полученных микобактериальных культур Проведение развернутого молекулярно-генетического типирования лекарственно-устойчивой выборки методами MIRU-VNTR и/или сполиготипирования, а также субтипирование наиболее распространенных в популяции штаммов семейств Beijing, LAM и Ural Выявление методамы ДНК-ДНК гибридизации генетические полиморфизмы, обуславливающие наличие пре-ШЛУ и ШЛУ среди распространенных в Казахстане генотипов M. Tuberculosis (продолжение) Сопоставление результатов бактериологических и генетических тестов лекарственной устойчивости и сформировать выборку образцов для секвенирования целевых генов Секвенирование целевых генов для штаммов имеющих расхождения в результатах фенотипических и генетических анализов лекарственной устойчивости
Дизайн исследования
Объем выборки: 1500 микобактериальных культур, выделенных от пациентов с лекарственно-устойчивыми формами туберкулеза. Методы исследования: • Посев и проведение тестов на лекарственную чувствительность к препаратам первого и второго ряда на плотной среде Левенштейна-Йенсена; • Проведение тестов на лекарственную чувствительность к препаратам первого ряда на жидкой среде с использованием автоматизированной системы MGIT BACTEC -960; • Автоматизированная система GeneXpert (Xpert MTB / RIF) для выявления возбудителя туберкулеза и устойчивости к рифампицину; • Метод линейных зондов LPA (Line Probe Assay) MTBDRplus для выявления туберкулеза и туберкулеза с множественной лекарственной устойчивостью на системе HAIN; • Автоматизированная система Exiprep/Existation для выявления туберкулеза и туберкулеза с множественной лекарственной устойчивостью; • Выделение ДНК из микобактериальных культур и методы пробоподготовки образцов для секвенирования и других видов генетического анализа; • Методы генотипирования: MIRU-VNTR, сполиготипирование и ДНК-дактилоскопия на основе анализа специфических однонуклеотидных полиморфизмов; • Статистический и филогенетический анализ; • Анализ панели 120 однонуклеотидных полиморфизмов, ассоциированных с лекарственной устойчивость к препаратам первого и второго ряда путем ДНК-ДНК гибридизации на биологических чипах; • Таргетное секвенирование отдельных генов и полногеномное штаммов в случае неэффективности таргетного подхода. Соисполнитель исследования: РГП на ПХВ «Национальный научный центр фтизиопульмонологии» МЗ РК



Свежие комментарии